
Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Почему приживаемость клеток–фоторецепторов не достигает 100 %: выяснены ключевые механизмы
Last reviewed: 05.08.2025
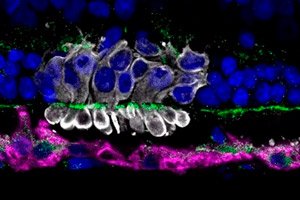
Учёные из Университета Пенсильвании под руководством Рагхави Судхарсана выяснили, почему около 70 % пересаженных фотосенсорных предшественников (PRPCs) из индуцированных плюрипотентных стволовых клеток гибнут уже в первые дни после трансплантации в сетчатку. Их работа, опубликованная в Stem Cell Research & Therapy, указывает на метаболический стресс донорских клеток как главный виновник ранней потери .
Предпосылки
Пересадка PRPCs рассматривается как многообещающий подход при прогрессирующих дегенеративных заболеваниях сетчатки (пигментном ретините, макулодистрофии). Но низкая выживаемость донорских клеток ограничивает эффективность терапии. До сих пор основной упор делался на подавление иммунного ответа, однако даже при обширной иммуносупрессии потери оставались катастрофическими.
Дизайн и методы
-
Модели:
-
Здоровые собаки и собаки-модели пигментного ретинита получали субретинальные инъекции PRPCs, меченых флуоресцентным маркером.
-
-
Оценка выживаемости:
-
Флуоресцентная ангиография и оптическая когерентная томография (OCT) фиксировали объём пересаженных клеток в первые сутки, на 3 и на 7-й день.
-
-
Транскриптомика одиночных клеток (scRNA-seq):
-
PRPCs извлекали из ретинальных участков на 3-й день и анализировали экспрессию генов, связанных с метаболизмом и апоптозом.
-
-
Иммуногистохимия:
-
Оценивали маркеры окислительного стресса (4-HNE), состояние митохондрий (Tom20) и активацию микроглии (Iba1) в зоне трансплантата.
-
Основные результаты
- Массовая потеря клеток: около 70 % PRPCs исчезали к 7-му дню и в здоровых, и в дегенерирующих сетчатках, несмотря на иммунодепрессию.
- Метаболический стресс: scRNA-seq выявил резкое снижение экспрессии генов окислительного фосфорилирования (CYCS, COX4I1) и увеличение транскрипции апоптотических маркеров (BAX, CASP3).
- Митохондриальная дисфункция: иммуногистохимия показала фрагментацию и потерю маркировки Tom20 в пересаженных PRPCs, а повышенный уровень 4-HNE свидетельствовал об окислительном повреждении.
- Роль микроглии: в зоне трансплантата активность Iba1⁺ микроглиальных клеток возрастала в ответ на гибель PRPCs, что могло усугублять локальное воспаление и способствовать дальнейшим потерям.
Значение для клеточных терапий
Эти данные меняют парадигму: чтобы увеличить приживаемость PRPCs, нужно не только подавлять иммунный ответ, но и поддерживать энергетический метаболизм донорских клеток. Возможные интервенции:
- Предварительный «метаболический предтренинг» PRPCs в штатных условиях культивирования на грани субстресс-нагрузки, чтобы усилить их митохондриальную устойчивость.
- Коктейли митохондриальных стабилизаторов (кофермент Q₁₀, карнитин) во время и сразу после трансплантации.
- Модуляция местного микроокружения сетчатки: доставка антиоксидантов или митохондриопротекторов в зону пересадки.
Практические выводы и перспективы
- Метаболическая предокондиционирование: подготовка PRPCs в условиях лёгкого метаболического стресса до трансплантации, чтобы повысить их устойчивость.
- Скaffold-доставка: использование биоразлагаемых матриц, обеспечивающих постепенный переход донорских клеток из богатой средой культивирования в среду сетчатки.
- Нутриентная поддержка: доставку антиоксидантов или субстратов митохондриального дыхания совместно с PRPCs.
«Мы долго боролись только с иммунным барьером, но теперь ясно, что без решения проблемы метаболического шока трансплантаты обречены на раннюю гибель», — подытоживает Рагхави Судхарсан.
Работа, поддержанная National Eye Institute, прокладывает путь к созданию более жизнеспособных клеточных препаратов для восстановления зрения у пациентов с дегенеративными заболеваниями сетчатки.
