
Весь контент Web2Health проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Мембранный холестерин: новая мишень при колоректальном раке
Last reviewed: 06.08.2025
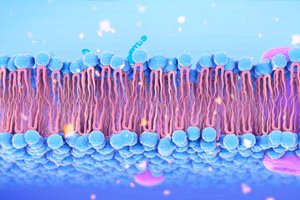
Колоректальный рак (КРР) часто связан с мутациями гена-супрессора APC, приводящими к неконтролируемой активации Wnt-сигналинга и росту опухоли. В новом обзоре в Trends in Pharmacological Sciences Cho и соавторы подробно описывают, как при дефекте APC на клеточной мембране накапливается свободный холестерин, который, меняя физико-химические свойства липидного бислоя, усиливает передачу Wnt-сигнала через ключевой медиатор Dishevelled (Dvl) и транскриптор β-catenin.
Что происходит на мембранном уровне?
-
Регуляция холестерина APC
-
Нормальный APC участвует в эндоцитозе и утилизации мембранного холестерина, поддерживая его оптимальный уровень.
-
При мутации APC этот контроль нарушается, и в участках мембраны слипается избыточный свободный холестерин.
-
-
Уплотнение мембраны и локализация Dvl
-
Повышенная доля холестерина делает мембрану более жёсткой и способствует кластеризации микродоменов, где располагаются участки связывания Wnt-рецепторов.
-
Dvl, центральный адаптер в Wnt-пути, прочно ассоциируется с этими доменами, что усиливает его передачу сигнала к β-catenin.
-
-
Активированная трансдукция
-
Длительная активация Dvl повышает уровень β-catenin в цитозоле, его транслокацию в ядро и запуск пролиферативной транскрипции, что стимулирует рост и выживаемость раковых клеток.
-
Экспериментальные доказательства и терапевтические стратегии
- Органоиды и клеточные линии: при обработке специфическими холестерин-вендинговыми лигандами или мембраностабилизаторами мы наблюдали снижение кластеризации Dvl, падение активности β-catenin и торможение роста КРР-органоидов.
- Модели на мышах: системное или локальное введение препаратов, вытесняющих холестерин из мембранных микродоменов, привело к 40–60 % замедлению прогрессирования опухоли без значимой токсичности для нормальных тканей.
Преимущества нового подхода
-
Не целиться в β-catenin напрямую
— столь популярные, но трудно достижимые внутриклеточные онкобелки заменяются мембранным холестерином, проще доступным таргетом. -
Высокая селективность
— за счёт локальной доставки (гидрогели, липосомы) можно ограничить действие препаратов в опухолевой зоне, избегая системных эффектов. -
Репозиционирование
— многие статин-подобные и мембраностабилизирующие соединения уже одобрены для других показаний и могут быть быстро проверены в клинике КРР.
Цитаты авторов
«Потеря APC — не только молекулярная детская ошибка Wnt-пути, но и мембранный феномен: избыток свободного холестерина задаёт жёсткость липидного бислоя и усиливает локальную активацию Dvl», — объясняет А. Erazo-Oliveras, старший автор обзора.
«Таргетинг мембранного холестерина открывает новый путь прецизионной терапии КРР: гораздо проще вмешаться в состав мембраны, чем искать ядро β-catenin», — добавляет В. Cho.
Дальнейшие шаги
- Клинические исследования: фазы I/II для холестерин-модуляторов в комбинации с химиотерапией и иммунотерапией.
- Индивидуализация лечения: стратификация пациентов по статусу APC-мутаций и мембранного холестерина для максимальной пользы.
- Контроль безопасности: изучение влияния долгосрочной модуляции холестерина на функции других тканей.
Это открытие не только объясняет новый механический аспект Wnt-активации в колоректальном раке, но и прокладывает дорогу к «мембранной терапии», где холестерин становится Achilles’ heel опухоли.
